电池工作原理
1. 引言 2. 电池电源和使用方法 |
引言
电池无处不在——在汽车、计算机、笔记本电脑、便携式MP3播放器以及手机中都有它的身影。电池实际上是一个由大量可以生成电子的化学物质组成的装置,生成电子的化学反应称为“电化学反应”。本文从电池的基本工作原理、电池内部发生的实际化学反应、电池未来的发展前景以及可能会取代电池的能量源等方面对电池进行了全面介绍。
如果你留意一下电池,便会发现它有两个端子。一个端子标记为(+)(正极),另一个端子标记为(-)(负极)。在AA型、C型或D型电池(普通的手电筒电池)中,电池的两端便是端子。在大型的汽车蓄电池中,有两个较重的极柱用作端子。
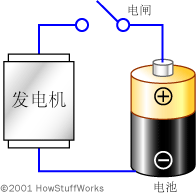 |
电池内部的化学反应可生成电子,两个端子之间流动的电子数量取决于此化学反应生成电子的速度(电池的内部电阻)。电子从电池流入金属线,并且必须从负极端子流向正极端子才会发生化学反应。这就是电池在闲置一年以后仍具有大量能量的原因——除非电子从负极端子流向正极端子,否则将不会发生化学反应。当连接金属线后,将开始发生化学反应。
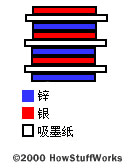
1800年,Alessandro Volta(伏特)发明了第一块电池。为了制作这块电池,他将锌片、用盐水浸泡过的吸墨纸和银片交替堆叠在一起,如图所示:
 |
在十八世纪发电机诞生之前(发电机于十八世纪70年代诞生并得到完善),Daniell电池(另有三个别名:因锌电极的典型形状而得名的“Crowfoot电池”,因重力使两种硫酸盐分开而得名的“重力电池”,以及因为使用液体电解质而得名的“湿电池”,它与现代“干电池”正相反)是极为普遍的电报和门铃供电装置。Daniell电池是由铜极板和锌极板以及硫酸铜和硫酸锌组成的湿电池。
 |
要制作Daniell电池,请将铜极板置于玻璃瓶的底部。向铜极板上倒入半瓶硫酸铜溶液。然后将锌极板悬于瓶中(如图所示),并慢慢将硫酸锌溶液倒入瓶中。由于硫酸铜的密度大于硫酸锌,因此硫酸锌将“悬浮于”硫酸铜之上。显而易见,这种方法并不适用于手电筒,但对于固定设备却比较适合。如果你可以使用硫酸锌和硫酸铜,则可以尝试自制一个Daniell电池。
实验
如果要了解用于制作电池的电化学反应,可以轻松地在家进行实验,以尝试不同的组合。要准确地进行这些实验,您需要在当地的电子市场或硬件商店购买一个廉价(10美元至20美元)的伏特-欧姆表。确保伏特-欧姆表可以显示低电压(位于1伏范围内)和低电流(位于5至10毫安范围内)。这样,您便可以确切看到电池发生的反应。
首先,可以使用硬币和纸板自制一个伏打电堆。将盐与水混合在一起(尽量达到饱和),并将纸板浸入盐水中。然后将一美分硬币和五美分硬币交替堆叠在一起,查看电堆生成的电压和电流读数是多少。改变电堆的层数,并查看它对电压的影响。节日尝试交替堆叠一美分硬币和十美分硬币,并查看结果如何。也可以交替堆叠十美分硬币和五美分硬币。还可以尝试使用的其他金属包括铝箔和钢,而每个金属组合都会生成略微不同的电压。
 |
另一个可以尝试的实验需要使用婴儿食品罐(如果你的家里没有婴儿,只需在商场购买几个婴儿食品罐,然后将其中的食品全部倒出即可)、稀酸、金属线和钉子。向罐中倒满柠檬汁或醋(稀酸),然后将一根钉子和一根铜线放入罐中,使其互不接触。可以尝试使用镀锌钉和普通的铁钉。然后将伏特表与钉子和铜线连接在一起,测量电压和电流。将柠檬汁替换为盐水,并使用其他硬币和金属,可以查看其对于电压和电流的影响。
你可以制作的最简单的电池或许称作锌碳电池。通过了解该电池内部发生的化学反应,你可以对电池的基本工作原理有所了解。
假设有一瓶硫酸(H2SO4),将锌棒放入其中后,硫酸会立即将锌棒溶解。随后会看到锌棒上生成了氢气气泡,此时锌棒和硫酸将开始变热。下面介绍了所发生的化学反应:
- 硫酸分子离解为三个离子:两个H+离子和一个SO4--离子。
- 锌棒表面上的锌原子失去两个电子(2e-),变为Zn++ 离子。
- Zn++离子与SO4--离子结合生成ZnSO4,后者溶解于硫酸。
- 锌原子失去的电子与硫酸中的氢离子结合生成H2分子(氢气)。因此我们看到锌棒上产生了氢气泡。
- 电子流经金属线并与碳棒上的氢结合,因此碳棒上开始产生氢气泡。
- 热量已经减少。可以使用流经金属线的电子为电灯泡或相似负载供电,并可以测量金属线的电压和电流,而某些热能已转化为电子移动。
而电子很难移动到碳棒,因为它们更容易与碳棒上的氢结合。该电池将产生0.76伏的特征电压。最终,锌棒将完全溶解,或硫酸中的氢离子被耗光,从而使电池“耗尽”。
电池电源和使用方法
任何电池的内部均发生相同类型的电化学反应,从而导致电子从一极移动到另一极。电池的电压取决于实际使用的金属和电解液——每个不同的反应都具有一个特征电压。例如,下面介绍了汽车铅酸蓄电池的某个电池单元中发生的电化学反应:
- 该电池单元有两个极板,一个是铅极板,另一个是二氧化铅极板,两个极板浸泡在强硫酸电解液中。
- 铅与SO4结合生成PbSO4和一个电子。
- 二氧化铅、氢离子和SO4离子以及铅极板中的电子在二氧化铅极板上生成PbSO4和水。
- 电池放电时,两个极板上均生成PbSO4(硫酸铅),而硫酸中生成水。每个电池单元的特征电压大约为2伏,因此六个电池单元组合在一起构成了一个12伏蓄电池。
铅酸蓄电池有一个很好的特性,即反应完全可逆。如果在适当的电压下向电池充电,两个极板上将再次生成铅和二氧化铅,从而可以不断地重复使用蓄电池。在锌碳电池中,由于很难使氢气返回到电解液中,因此很难发生逆向反应。
现代电池使用各种化学物质为反应提供能量。典型的化学电池包括:
- 锌碳电池——(也称为标准碳电池)所有廉价的AA型、C型和D型干电池均使用锌碳化学物质。电极为锌和碳,两极之间采用酸性糊状液体作为电解液。
- 碱性电池——用于常见的Duracell(金霸王)和Energizer(劲量)电池,电极为锌和二氧化锰,并使用碱性电解液。
- 照相机锂电池——照相机中的电池使用锂、碘化锂和碘化铅,因为它们能够提供电涌保护。
- 铅酸电池——用于汽车,电极为铅和二氧化铅,并使用强酸电解液(可充电)。
- 镍镉电池——电极为氢氧化镍和镉,并使用氢氧化钾作为电解液(可充电)。
- 镍金属氢化物电池——此类电池将很快取代镍镉电池,因为前者不存在记忆效应,而后者却存在(可充电)。
- 锂离子电池——由于具备极佳的功率重量比,因此此类电池通常用于高端笔记本电脑和手机(可充电)。
- 锌空气电池——此类电池重量轻,并可以充电。
- 锌汞电池——此类电池通常用于助听器。
- 锌银电池——由于具备良好的功率重量比,因此此类电池用于航空航天设备。
- 金属氯化物电池——此类电池用于电动车。
在几乎所有使用电池的设备中,你都不可能一次仅使用一个电池单元。通常需要将电池单元串联在一起形成更高的电压,或将其并联在一起形成更高的电流。使用串联结构可以增加电压。使用并联结构可以增加电流。下图显示了这两种结构:
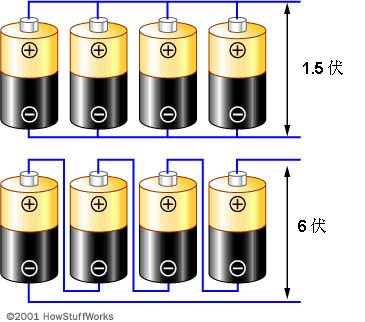 |
上面的结构称为“并联”结构。如果假设每个电池单元生成1.5伏电压,则四个并联电池也将生成1.5伏电压,但提供的电流却为单个电池单元的四倍。下面的结构称为“串联”结构。四个电压加在一起将生成6伏电压。
通常情况下,当你购买电池包时,包装上会显示电池的额定电压和额定电流。例如,我的数码相机使用四节镍镉电池,每个电池单元的额定电压为1.25伏,额定电流为500毫安时,额定毫安时表示电池理论上可以在一小时内生成500毫安的电流。您可以将额定的毫安时划分为多种不同的形式,一个500毫安时的电池可以在100小时内生成5毫安电流,在50小时内生成10毫安电流、在20小时内生成25毫安电流,或(在理论上)在1小时内生成500毫安电流,甚至在30分钟内生成1,000毫安电流。
但电池并不具备如此高的线性。首先,所有电池都有一个额定的最大电流——一个500毫安时的电池无法在1秒内生成30,000毫安电流,原因是该电池的化学反应无法在如此短的时间内发生,并且在更高的电流强度下,电池会生成大量热量,从而损失了某些能量。此外,在极低的电流强度下,许多化学电池的寿命可能会比预期的寿命长或短。但在通常的使用范围内,可以对额定毫安时进行一定程度的线性划分。使用额定的毫安时,可以粗略估计电池在给定负载下的持续供电时间。
如果将四个1.25伏、500毫安时的电池串联在一起,则最终的电压为5伏(1.25x4),电流为500毫安时;如果将这四个电池并联在一起,则最终的电压将为1.25伏,电流为2,000(500x4)毫安时。
您是否见过普通9伏电池的内部结构?
 |  |
该电池包含6个非常小的电池,每个电池在串联结构中可以生成1.5伏电压!

 我要赚赏金
我要赚赏金

